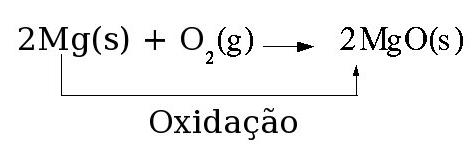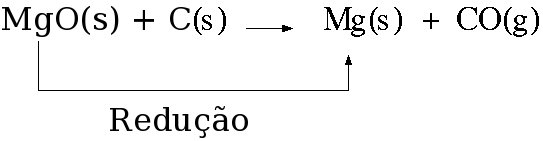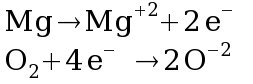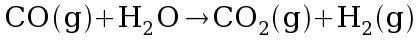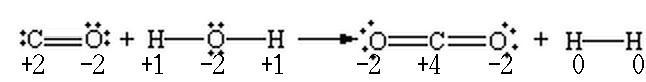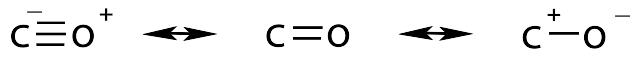8. Recapitulando a Oxidação e a Redução[2]
Originalmente o termo "oxidação" foi usado para reações onde um elemento se combina com oxigênio.
Já o termo "redução" tem origem latina e significa "voltar ao ponto de partida". Portanto qualquer reação que "retorne" ao magnésio metálico é uma reação de redução.
A reação entre o óxido de magnésio e carbono a 2000°C para formar magnésio metálico e monóxido de carbono é um exemplo da redução do óxido de magnésio a magnésio metálico.
Com a descoberta dos elétrons, os químicos ficaram convencidos que as reações de oxidação-redução envolvem a transferência de elétrons entre os átomos.
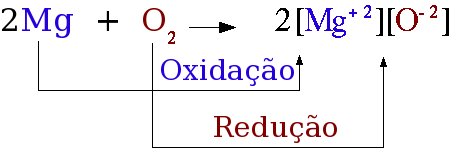
Cada átomo de magnésio perde 2 elétrons para formar um íon Mg+2 enquanto que cada molécula de O2 recebe 4 elétrons para formar um par de íons O-2.
Os elétrons não são criados nem destruídos em uma reação, por isso as reações de oxidação e redução estão associadas.
Não é possível ocorrer uma redução sem uma oxidação.
Os átomos em ligações covalentes compartilham os elétrons entre si e por isso, ao contrário dos íons, não se aplica o termo “estado de oxidação”. Nesse caso utiliza-se o conceito de “carga formal”.
Isto ocorre porque os elétrons em uma ligação covalente não estão igualmente distribuidos quando os átomos da ligação apresentam diferentes graus de eletronegatividade[3]
Por exemplo, em uma ligação entre oxigênio e carbono, o oxigênio apresenta maior eletronegatividade do que o carbono e por isso atrai para si a "nuvem" de elétros apresentando um estado de oxidação negativo, enquanto o carbono apresenta um estado de oxidação positivo.
Considere a reação:
Nesta reação não ocorre uma troca de elétrons, mantendo constante o número de elétrons na camada de valência:
O que muda nesta reação é o estado de oxidação dos átomos. O estado de oxidação do carbono aumenta de +2 para +4 enquanto que o estado de oxidação do hidrogênio diminui de +1 para 0.
Para facilitar o entendimento, imagine, que na quebra das 2 ligações covalentes do monóxido de carbono (CO), onde existem 4 elétrons envolvidos, as duas ligações sofrem heterólise[4] devido à maior eletronegatividade do oxigênio.
Neste caso o oxigênio ficaria com um excesso de 2 elétrons na camada de valência e portanto teria uma carga formal de -2, enquanto que o carbono teria uma deficiência de 2 elétrons e portanto uma carga de +2.
A rigor, a estrutura do monóxido de carbono é melhor representada por 3 estruturas de ressonância com predominância da estrutura com 3 ligações e carga negativa sobre o átomo de carbono. Para melhor entender as ligações químicas do monóxido de carbono é necessário a teoria do Orbital Molecular.
A oxidação, em ligações covalentes, portanto pode ser definida como a reação onde a carga formal de um átomo aumenta enquanto a redução ocorre quando a carga formal do átomo diminui.
Algumas dicas:
O número de oxidação do oxigênio em compostos é sempre -2, exceto em peróxidos onde vale -1.
O número de oxidação do hidrogênio em compostos é sempre +1, exceto em hidretos onde vale -1.
O número de oxidação do carbono em compostos inorgânicos (CO2 e carbonatos) é sempre +4, exceto no monóxido de carbono onde vale +2.
A carga formal do carbono em compostos orgânicos é variável. Na sua forma mais reduzida, metano, vale -4.