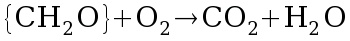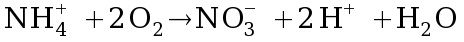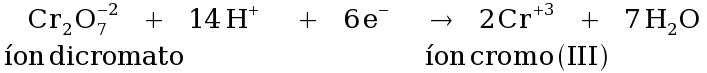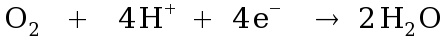Os fenômenos ácido-base e de solubilidade controlam predominantemente as concentrações dos íons inorgânicos dissolvidos na água, como o carbonato, enquanto que o teor de matéria orgânica e oxigênio é controlado, principalmente, por reações redox.
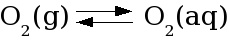
O agente oxidante mais importante em águas naturais bem aeradas é o oxigênio molecular (O2) dissolvido, o qual passa do estado de oxidação 0 para -2. As semi-reações de redução que ocorrem entre o oxigênio atmosférico em equilíbrio com água em diferentes pHs estão descritas a seguir.
Figura 31. Semi-reações de redução que ocorrem entre o oxigênio atmosférico em equilíbrio com água em diferentes pHs.
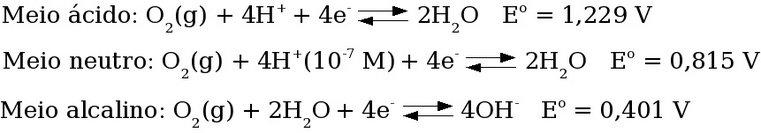
Pergunta: Considerando apenas o pH, em que meio é mais favorável a oxidação pelo oxigênio?
A concentração de saturação de oxigênio dissolvido em água é baixa (~8,3 mg/L). Para a reação:
a constante de equilíbrio é dada pela Lei de Henry, que, para o oxigênio a 25 °C, tem um valor de 1,28 x 10-3 mol x L-1 x atm-1.
Problema: Calcule a concentração de equilíbrio de oxigênio dissolvido em água em equilíbrio com oxigênio atmosférico.
Para a maioria dos microrganismos, os processos de armazenamento e consumo de energia para manutenção dos processos vitais envolvem mudanças no estado de oxidação do carbono.
Por exemplo a oxidação de matéria orgânica de origem biológica, representada por CH2O (considerado como carbohidrato polimerizado), pelo oxigênio dissolvido na água, resulta na liberação de energia e na oxidação do carbono do número de oxidação 0 (CH2O) para +4 (CO2) além de reduzir a concentração de oxigênio dissolvido na água, o que pode comprometendo a sobrevivência das espécies que dependem do oxigênio dissovido (Ex: peixes, crustáceos etc).
O oxigênio dissolvido também é utilizado nas reações de oxidação de amônia (NH3) e do íon amônio (NH4+) na formação do íon nitrato (NO3 -). Reações catalisadas pelas bactérias nitrificantes.
DBO é a quantidade de oxigênio consumido, em uma amostra de água, como resultado da oxidação da matéria orgânica pelos microrganismos presentes no meio.
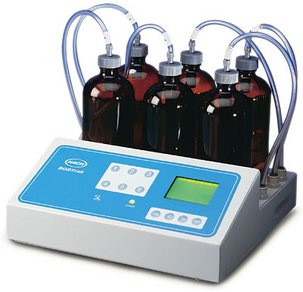
É avaliada experimentalmente determinando a concentração de O2 (dissovido) inicial e após 5 dias de incubação em uma amostra selada de água, mantida no escuro [5] e à temperatura constante, normalmente 25 °C.
Figura 35. Frasco de DBO, incubadora e determinação eletrométrica do Oxigênio Dissolvido (OD), na determinação "tradicional" da DBO.

Quando a amostra tiver um valor de DBO elevado, ela é diluída com água pura saturada de oxigênio, para garantir que após o período de 5 dias ainda haja oxigênio disponível para leitura corrigindo-se os resultados conforme a diluição.
A oxidação bioquímica é um processo lento e teoricamente o processo se completa em um tempo infinito. Usualmente permite-se que a reação se prolongue por 5 dias antes da determinação do oxigênio residual.
A DBO determinada dessa forma é denominada DBO5 e corresponde a cerca de 60 a 80% da DBO total, ou completa. A DBO total pode ser determinada a partir da DBO5 com o uso de modelos matemáticos (OD e DBO - Universidade Politécnica de Nova York).
Figura 36. Modelo dos Mínimos Quadrados aplicado a um conjunto de dados de DBO (mg/L) em função do tempo (dias).
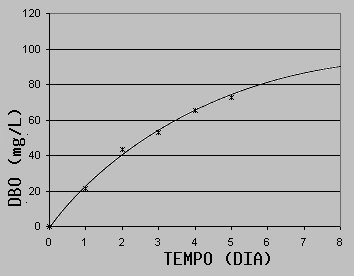
Apenas como referência, a DBO5 média para água superficial, não poluída é de cerca de ~0,7 mgO2/L, consideravelmente menor que a concentração de saturação de oxigênio em água (~8,3 mgO2/L), ao contrário dos valores para efluentes que podem chegar a várias centenas de mgO2/L.
E a resolução CONAMA n. 357/05 estabelece os seguintes limites de DBO5 e OD para os rios classe 1, 2 e 3:
rio classe 1: DBO5 <= 3,0 mgO2/L e OD >= 6,0 mgO2/L
rio classe 2: DBO5 <= 5,0 mgO2/L e OD >= 5,0 mgO2/L
rio classe 3: DBO5 <= 10,0 mgO2/L e OD >= 4,0 mgO2/L
As alternativas automatizadas para avaliação da DBO utilizam essencialmente a variação da pressão resultante do consumo de oxigênio durante processos biológicos.(Eduardo L. Oliveira, e colaboradores, 2005)
Mas e o CO2 formado durante o processo de degradação aeróbica?
Para remover o CO2 formado, costuma-se utilizar pastilhas de algum hidróxido (Ex: hidróxido de lítio) para reagir com o CO2 da fase gasosa permitindo que se possa correlacionar a queda de pressão com o consumo de O2.
Outra alternativa de monitoramento automatizado da DBO em estações de tratamento de efluentes pode ser encontrada no site www.envitech.co.uk.
Para se estimar a demanda de oxigênio da amostra e permitir uma correta diluição para a determinação da DBO usa-se a demanda química de oxigênio, DQO.
No lugar do oxigênio dissolvido, é usado o íon dicromato, Cr2O7-2, na forma de um de seus sais (K2Cr2O7), dissolvido em ácido sulfúrico juntamente com sulfato de prata (catalisador) e sulfato de mercúrio (para minimizar a interferência de cloreto), resultando em um poderoso agente oxidante, mas também um poderoso resíduo poluente contendo mercúrio, prata e cromo.
Na prática adiciona-se à amostra um excesso de dicromato, e a solução resultante pode ser analisada por retrotitulação com Fe+2 até o ponto final ou determinando por espectrofotometria o consumo de Cr+6, que absorve na região de 400 nm ou a produção de Cr+3 que absorve na região de 600 nm.
Considera-se que o número de mols de oxigênio que a amostra teria consumido na oxidação do mesmo material é igual a 6/4 (=1,5) vezes o número de mols de dicromato, já que este último aceita 6 elétrons por íon enquanto que o oxigênio aceita apenas quatro:
Assim, o número de moles de O2 requeridos para a oxidação é 1,5 vezes o número de moles do dicromato consumido.
O maior inconveniente da determinação da DQO é o que fazer com o resíduo de análise contendo cromo, prata e mercúrio.
No endereço: www.glrppr.org e www.wmrc.uiuc.edu está disponível para download um trabalho sobre o tratamento desse tipo de resíduo usando técnicas de precipitação.
Além disso o artigo "Procedimento para recuperação de Ag de resíduos líquidos e sólidos"(Jose A. Bendassolli e colaboradores, 2003) traz informações para o tratamento parcial desses resíduos.
Na minha opinião, o reagente contendo prata, mercúrio e cromo, deveria ser praticamente abolido, pois não dispomos, no Brasil, de um sistema eficiente e confiável para o tratamento deste tipo de resíduo em escala industrial.
E além disso, gostaria de saber se existe algum laboratório, público ou privado, com estrutura para fazer a recuperação dos metais dos seus próprios resíduos gerados!
É uma grande incoerência que ainda se utilize esta técnica em estudos ambientais e de tratabilidade de efluentes líquidos.
Uma alternativa viável, seria o uso do permanganado de potássio no lugar do Cr/Ag/Hg como agente oxidante gerando um resíduo bem menos tóxico, ou a substituição da DQO pela determinação do Carbono Orgânico Total.
O dicromato, devido ao seu poder oxidante, oxida substâncias que não seriam oxidadas pelo O2 na determinação da DBO, como por exemplo a oxidação da celulose a CO2, e de Cl- a Cl2.
Por isso o valor de DQO de uma amostra de água é, em geral, maior que o valor da DBO.
No entanto, nenhum dos métodos de análise oxida hidrocarbonetos aromáticos (Ex: piridina) ou muitos compostos orgânicos voláteis.
Espécies inorgânicas reduzidas, tais como íon de ferro(II), sulfeto, Mn (II) são oxidadas quantitativamente apenas na determinação de DQO contribuindo para aumentar a diferença entre DQO e DBO.
O carbono orgânico total COT ( ou TOC em inglês), é usado para caracterizar a matéria orgânica dissolvida e em suspensão em água. Ao contrário da DBO e DQO o COT é independente do estado de oxidação da matéria orgânica e não sofre a interferência de outros átomos ligados à estrutura orgânica tais como o nitrogênio e hidrogênio, e espécies inorgânicas como Fe (II) , Mn (II), sulfeto e cloreto.
Lembrar que:
O foco da análise de COT é o Carbono.
É uma análise complementar mas que não substitui a DBO
Por exemplo, o valor habitual de COT para águas subterrâneas (não contaminadas!) é de aproximadamente 1 mgC/L enquanto que para águas superficiais é em média de 5 mgC/L, embora pântanos e lamaçais possam atingir valores da ordem de 50 mgC/L de carbono.
Esgoto não tratado pode atingir centenas de mgC/L.
O princípio da técnica consiste na clivagem (decomposição) de moléculas orgânicas e a liberação do carbono em uma forma molecular simples (CO2) que possa ser quantificada.
Os diferentes métodos usam basicamente a degradação térmica com alta temperatura, catalisadores e oxigênio ou a fotodegradação com UV apenas e/ou associado a oxidantes químicos (Ex: persulfato).
Os métodos e instrumentos usados para medir COT permitem determinar diferentes componentes do CT (Carbono Total) na amostra:
CI (Carbono Inorgânico - IC em inglês) - carbonato, bicarbonato, e CO2 dissolvido,
COT (Carbono Orgânico Total - TOC em inglês) - todos os átomos de carbono ligados covalentemente a moléculas orgânicas;
COT = CT - CI
Além do COT e CI é possível determinar:
COD (Carbono Orgânico Dissolvido - DOC em inglês) - a fração de COT que passa por membrana com diâmetro de poro de 0,45 μm,
Carbono orgânico em suspensão - a fração de COT que fica retido em membrana com diâmetro de poro de 0,45μm
Carbono orgânico volátil - a fração de COT que é liberada pela passagem de um gás inerte na amostra (N2);
Carbono orgânico fixo (não volátil) - a fração de COT que não é liberada pela passagem de um gás inerte na amostra.
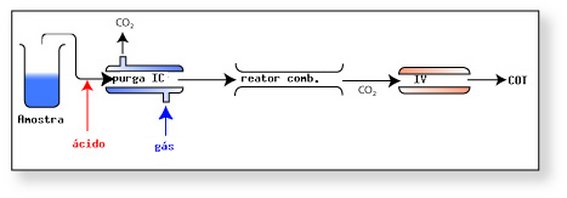
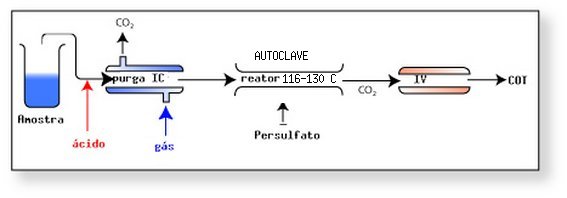
Neste sistema a amostra é misturada com ácido até pH ~2 e bombeada para um compartimento onde é borbulhado um gás inerte para liberação do CO2 dissolvido.
A amostra livre de carbonato é continuamente bombeada para um reator de combustão onde o carbono orgânico remanescente é oxidado a CO2 com alta temperatura, e o CO2 liberado é quantificado pela absorção de radiação infravermelho.
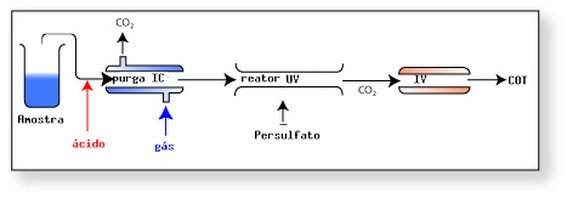
Neste sistema a amostra é misturada com ácido até pH ~2 convertendo o carbono inorgânico em CO2 dissolvido e bombeada para um compartimento onde é borbulhado um gás inerte para liberação do CO2 dissolvido.
A amostra livre de carbonato é misturada com persulfato e continuamente bombeada para um reator de irradiação com UV onde o carbono orgânico remanescente é oxidado a CO2 o qual é quantificado pela absorção de radiação infravermelho.
Neste sistema a degradação é feita por oxidação com persulfato em autoclave e aquecimento na faixa de 116-130°C.
O método por combustão geralmente é mais adequado para amostras com compostos químicos mais refratários ou amostras contendo altas concentrações de carbono orgânico em suspensão. Entretanto exige cuidado com o tamanho de partícula em suspensão para evitar entupimentos da agulha de amostragem. Apresenta um limite de detecção de ~1mgC/L.
Os métodos oxidativos, com UV ou via úmida são mais adequados para soluções mais diluídas (< 1mgC/L) com limites de detecção da ordem de 0,01 mg/L.
O método de oxidação via úmida pode ser usado para sedimentos e água do mar mas não é recomendado para amostras contendo altas concentrações de compostos orgânicos voláteis.
[5] Na presença de luz, as algas absorvem CO2 durante a fotossíntese, (carbono muda o seu estado de oxidação de +4 (CO2) para 0 (CH2O)) liberando O2 e portanto interferindo na determinação do consumo real de oxigênio.