Todo instrumento tem seus “limites”, que podem ser relativos a: exatidão, precisão, sensibilidade, seletividade, faixa de lineridade, estabilidade das leituras ao longo do tempo, robustez às condições ambientais, usabilidade.
É importante avaliar esses limites para saber se um determinado instrumento consegue atender a uma determinada demanda e portanto oferecer dados que possam ajudar a responder perguntas.
Ou seja, as perguntas precisam estar compatíveis com o que o instrumento é capaz de responder.
Outra questão importante é analisar um instrumento como um sistema formado por diferentes componentes. E da mesma forma que a resistência de uma corrente é definida pelo seu elo mais fraco; a performance de um instrumento pode ser muito comprometida por apenas 1 único componente do sistema.
Os dados enviadas pelo Arduino, são as leituras analógicas do conversor ADC, no intervalo de 0-1023 correspondemtes respectivamente ao intervalo de tensão de 0-5V.
Essa tensão lida pela placa Arduino é o sinal de tensão gerado pelo amplificador operacional e é proporcional à intensidade de luz incidente sobre o LED sensor (I).
No entanto as leituras de absorbância são calculadas pela fórmula:
Absorbância = Log10(I0/I)
Onde:
I0 : intensidade luminosa do “branco”
I: intensidade luminosa da amostra
A fotocorrente produzida pelo LED, e convertida em tensão (V) pelo circuito das figuras 223 e 224, é proporcional à intensidade de luz incidente. Portanto a fórmula de absorbância pode ser calculada pelas leituras de tensão:
Absorbância = Log10(V0/V)
Onde:
V0 : leitura de tensão do LED detector com a passagem de luz pelo solvente “sem” o composto de interesse “branco”.
V: leitura de tensão do LED detector com a passagem de luz pela solução contendo o composto de interesse
A fórmula poderia ainda ser otimizada para compensar a “corrente de escuro” (Dark Current) que é medida desligando o LED emissor e registrando a tensão gerada na ausência de luz (VD).
Absorbância = Log10 ( (V0 - VD) / (V - VD )
Onde:
V0 : leitura de tensão do LED detector com a passagem de luz pelo solvente “sem” o composto de interesse “branco”.
V: leitura de tensão do LED detector com a passagem de luz pela solução contendo o composto de interesse
VD : leitura de tensão do LED detector com o LED emissor desligado.
Por isso implementamos um botão para executar os comandos necessários para armazenar as leituras correspondentes ao branco, para uso posterior no cálculo da absorbância das amostras. E mais um método na classe controllerStateInstrument chamado setBlank, para definir o valor médio da leitura do branco dentro da variável controller_attributes.
O modo de operação em fotocorrente apresentou estabilidade do sinal e amplitude de leitura adequada. Por isso foi o modo de operação esolhido ara avaliar a sensibilidade e a faixa de linearidade.
Para estes testes foi escolhido o sulfato de cobre (CuSO4.5H2, PM=249,69g) e o LED vermelho.
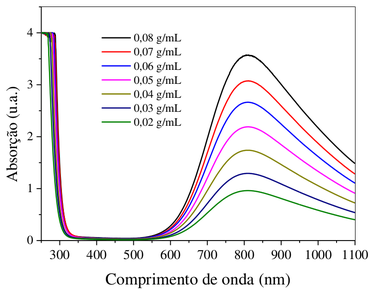
Como mostra a figura 289 a solução de sulfato de cobre II apresenta absorção máxima no comprimento de onda de 810nm, região do vermelho.
Figura 289. Espectro de absorção no UV-Vis das soluções de CuSO4 em diferentes concentrações. (Fonte: Utilização da lei de Lambert-Beer para determinação da concentração de soluções
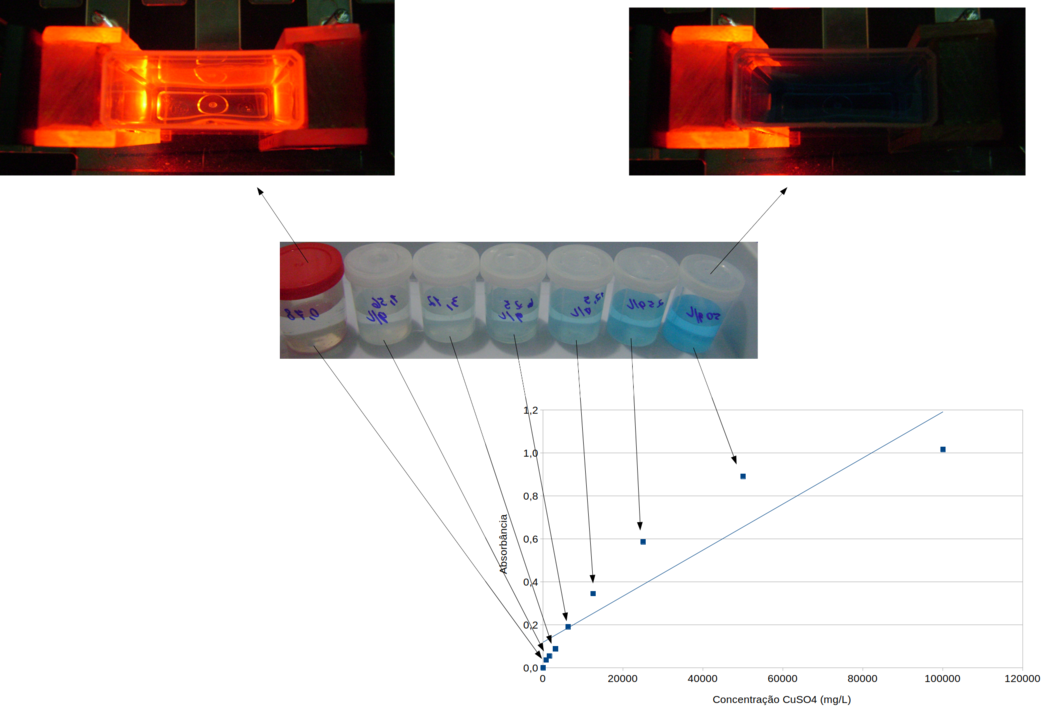
Para avaliar a sensibilidade e a faixa de linearidade preparei uma curva de calibração de sulfato de cobre (CuSO4.5H2, PM=249,69g) fazendo diluições sucessivas a partir de uma solução estoque a ~100.020 mg/L, pesando 50,01g de CuSO4.5H2O com uma minibalança digital de 2 casas decimais (Figura 290) e diluições sucessivas conforme o procedimento descrito na tabela 22:
Tabela 22. Tabela de diluições sucessivas para o preparo de uma curva de calibração de CuSO4 a partir de uma solução estoque preparada pela dissolução de 50,01g de CuSO4.5H2O em 500mL de água “filtrada” e sem cloro.
| Solução | Volume alíquota (mL) | Concentração alíquota (mg/L) | Volume final (mL) | Concentração final (mg/L) | [CuSO4] | Concentração final (g/L) |
|---|---|---|---|---|---|---|
| 1 | 25 | 100020 | 50 | 50010 | 0,200 | 50,01 |
| 2 | 25 | 50010 | 50 | 25005 | 0,100 | 25,00 |
| 3 | 25 | 25005 | 50 | 12502 | 0,050 | 12,50 |
| 4 | 25 | 12502 | 50 | 6251 | 0,025 | 6,25 |
| 5 | 25 | 6251 | 50 | 3125 | 0,012 | 3,12 |
| 6 | 25 | 3125 | 50 | 1562 | 0,006 | 1,56 |
| 7 | 25 | 1562 | 50 | 781,4 | 0,003 | 0,78 |
Como a solução de sulfato de cobre apresenta um máximo de absorbância em 810nm, região do vermelho, avaliamos a sensibilidade e faixa de linearidade para o LED infravermelho (detector) com as 8 soluções obtidas conforme a tabela 23.
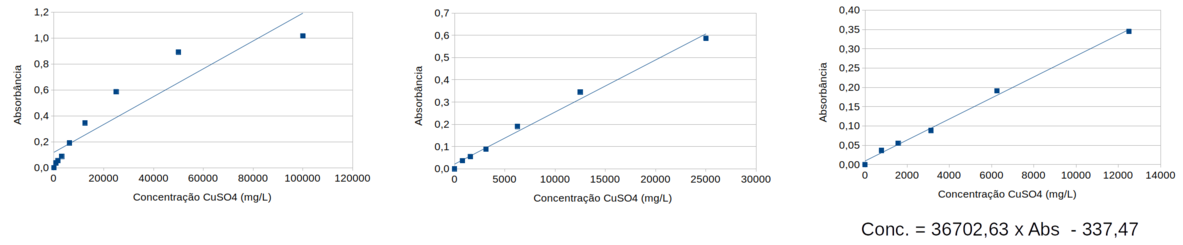
Tabela 23. Leituras de fotocorrente gerada pela incidência de luz sobre o LED infravermelho como fotodector, com diferentes soluções de CuSO4.5H2O (A fotocorrente (A) gerada é convertida em tensão (V) pelo circuito das figuras 223 e 224.
| Concentração CuSO4.5H2O (mg/L) | I (Volts) | Absorbância (Log10(I0/I)) |
|---|---|---|
| 0 | 4,36 | 0 |
| 781,41 | 4,01 | 0,036 |
| 1568,81 | 3,84 | 0,055 |
| 3125,65 | 3,56 | 0,088 |
| 6251,25 | 2,81 | 0,191 |
| 12502,5 | 1,97 | 0,345 |
| 25005 | 1,13 | 0,586 |
| 50010 | 0,56 | 0,891 |
| 100020 | 0,42 | 1,016 |
Gráficos de Absorbãncia X Concentração com os dados da tabela 23.
Figura 292. Imagem ilustrativa das soluções de CuSO4.5H2O usadas, com os respectivos resultados no gráfico. E duas imagens ilustrativas da absorção da luz vermelha para soluções com diferentes concentrações de CuSO4.5H2O.
A beterraba é uma raiz tuberosa de cor vermelho-arroxeada devido à presença de betalaínas. As betalaínas são produtos naturais provenientes do metabolismo secundário, e pertencente ao grupo dos compostos nitrogenados alcalóides. São “corantes” hidrossolúveis divididos em duas classes: as betacianinas (cor avermelhada) e as betaxantina (cor amarelada), caracterizando a coloração típica das raízes. Estes pigmentos, além de fornecerem cor à beterraba, são importantes substâncias antioxidantes para a dieta humana. (Fonte: Armazenamento refrigerado de beterraba minimamente processada em diferentes tipos de corte)
Procedimento para o preparo do extrato de beterraba:
Foram aquecidos à ebulição 500 mL de água e adicionados 101,16 g de beterraba cortada em pedaços de ~1 cm. O aquecimento foi interrompido logo após a adição da beterraba e o recipiente ficou resfriando em repouso por ~ 2h. Em seguida a solução foi filtrada em filtro de papel e o filtrado ficou em geladeira durante uma noite conforme a figura 293.
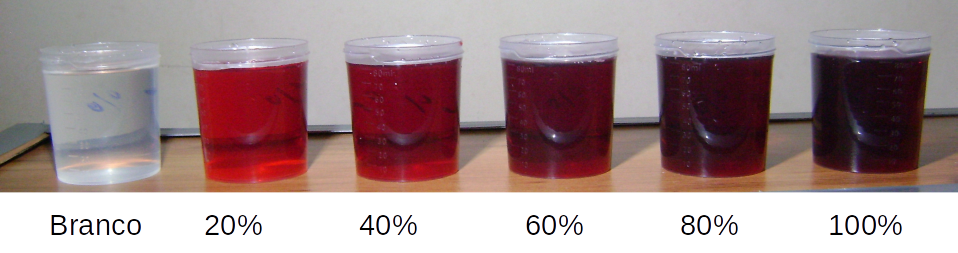
A partir do extrato bruto (100%) foram feitas diluições obtendo-se concentrações de 80%, 60%, 40% e 20% como mostra a figura 294.
Essas soluções foram analisadas com os LEDs UV, Azul, Verde e Vermelho, como mostra a figura 295.
Figura 295. Fotos das leituras do extrato bruto concentrado (100%) com os LEDs UV, Azul, Verde e Vermelho.

Mas estavam muito concentradas e foram feitas diluições sucessivas a partir da solução com 20% obtendo-se concentrações de: 20%, 10%, 5%, 2,5% e 1,25% como mostra a figura 296.
Essas soluções foram então analisadas com os LEDs UV, Azul, Verde e Vermelho, como mostra a figura 297.
Figura 297. Fotos da cubeta com o extrato bruto a (5%) exposta aos LEDs: UV, Azul, Verde e Vermelho.

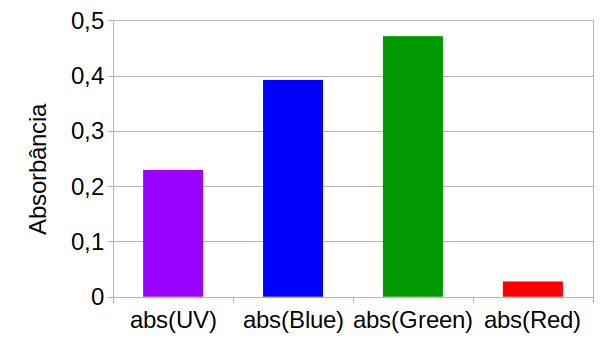
Tabela 24. Leituras de absorbância das soluções da figura 296 com os diferentes LEDs.
| Concentração do Extrato Bruto de Beterraba (%) | Leitura no UV (ADC) | Absorbância (UV) | Leitura no Azul (ADC) | Absorbância (Azul) | Leitura no Verde (ADC) | Absorbância (Verde) | Leitura no Vermelho (ADC) | Absorbância (Vermelho) |
|---|---|---|---|---|---|---|---|---|
| 0 | 796 | 0 | 370 | 0 | 469 | 0 | 621 | 0 |
| 1,25 | 700 | 0,05 | 294 | 0,10 | 352 | 0,12 | 604 | 0,01 |
| 2,5 | 608 | 0,12 | 230 | 0,21 | 264 | 0,25 | 594 | 0,02 |
| 5 | 469 | 0,23 | 150 | 0,39 | 159 | 0,47 | 583 | 0,03 |
| 10 | 286 | 0,44 | 85 | 0,64 | 84 | 0,74 | 560 | 0,04 |
| 20 | 131 | 0,78 | 62 | 0,77 | 63 | 0,87 | 485 | 0,11 |
Pode-se verificar pela figura 298 as absorbâncias relativas na faixa de 0-20% para os diferentes LEDs.
Figura 298. Gráfico de absorbância X concentração do extrato de beterraba com os LEDs UV, Azul, Verde e Vermelho.
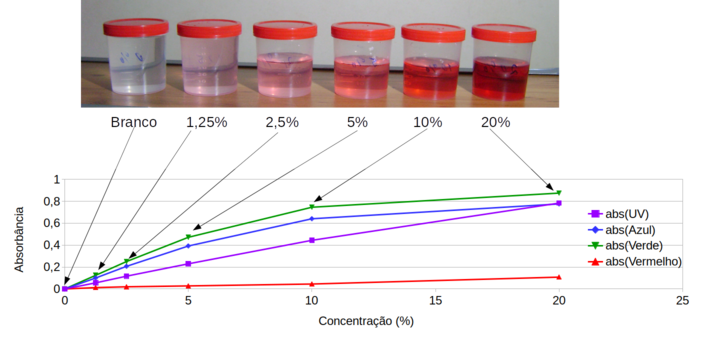
E pela figura 299 podemos verificar a maior absorbância na região do LED verde.
A clorofila é o pigmento mais importante no processo de fotossíntese, o processo pelo qual a energia da luz é convertida em energia química por plantas verdes e algas.
A clorofila ocorre em várias formas distintas, e as clorofilas “a” e “b” são os principais tipos encontrados nos cloroplastos de plantas verdes. Uma molécula de clorofila contém um íon Mg+2 coordenado aos nitrogênios de 4 anéis de porfirina.
A clorofila “a” atua como um centro de reação, capturando a energia da luz e convertendo-a em energia elétrica e química. Enquanto que a clorofila “b” constitui 25% do conteúdo total da clorofila e, semelhante aos pigmentos carotenóide e xantofila, atua como um pigmento acessório que amplia o espectro da luz absorvida durante a fotossíntese, transferindo sua energia para o centro da clorofila “a”. Durante a senescência, as folhas de uma planta verde começam a se decompor, as clorofilas são convertidas em feofitina, que muda a cor das folhas verdes para um cinza oliva. (Fonte: The Characterization of an Easy-to-Operate Inexpensive Student-Built Fluorimeter)
Para as medidas com clorofila foi preparado um extrato bruto etanólico de espinafre (Spinacia oleracea), a partir de ~44 g de folhas de espinafre picadas que foram colocadas em 250mL de etanol a 64°C (aquecido em banho maria) e o aquecimento foi interrompido. Após ~1h de resfriamento em infusão, com temperatura final de ~48°, a mistura foi filtrada em papel de filtro e estocada em geladeira durante uma noite. (Figura 300)
A partir do extrato bruto (100%) foi feita uma diluição inicial a 20% diluindo 16 mL do extrato bruto com etanol até o volume final de 80 mL. E a partir daí diluições sucessivas de 1:2 obtendo concentrações de: 20%, 10%, 5%, 2,5%, 1,25% e 0% como mostra a figura 301)
Essas soluções foram então analisadas com os LEDs UV, Azul, Verde e Vermelho, gerando os dados da tabela 25.
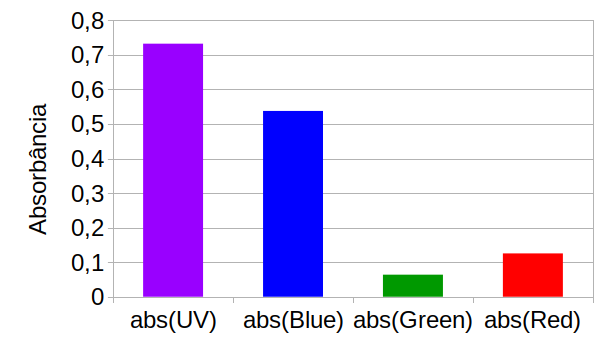
Tabela 25. Leituras de absorbância das soluções da figura 301 com os diferentes LEDs.
| Concentração do Extrato Bruto de Espinafre (%) | Leitura no UV (ADC) | Absorbância (UV) | Leitura no Azul (ADC) | Absorbância (Azul) | Leitura no Verde (ADC) | Absorbância (Verde) | Leitura no Vermelho (ADC) | Absorbância (Vermelho) |
|---|---|---|---|---|---|---|---|---|
| 0 | 712,6 | 0 | 369 | 0 | 773 | 0 | 826 | 0 |
| 1,25 | 461 | 0,19 | 281 | 0,12 | 754 | 0,01 | 739 | 0,05 |
| 2,5 | 278 | 0,41 | 193 | 0,28 | 722 | 0,03 | 700 | 0,07 |
| 5 | 132 | 0,73 | 107 | 0,54 | 667 | 0,06 | 619 | 0,12 |
| 10 | 84 | 0,93 | 67 | 0,74 | 556 | 0,14 | 471 | 0,24 |
| 20 | 81 | 0,94 | 61 | 0,78 | 361 | 0,33 | 308 | 0,43 |
O gráfico da figura 302 mostra as absorbâncias do extrato de beterraba diluído na faixa de 0-20% para os diferentes LEDs.
Figura 302. Gráfico de absorbância X concentração do extrato de espinafre com os LEDs UV, Azul, Verde e Vermelho.
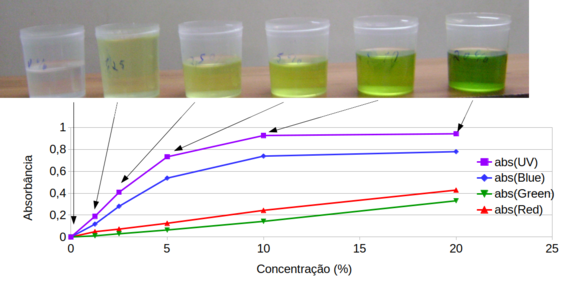
E pela figura 303 podemos verificar a maior absorbância na região do LED UV e Azul.
Para conhecer alguns fundamentos teóricos da Fluorescência visite a seção Sensor Óptico para Oxigênio Dissolvido (OD).
Conforme mensagem do fórum Fontes de erro em medidas de Fluorescência, a luz de excitação pode sofrer 4 processos:(Fonte Common Errors in Fluorescence Spectroscopy)
transmissão direta sem interação com a amostra
espalhamento Rayleigh (também chamado Mie ou espalhamento geométrico dependendo do comprimento de onda de excitação e do tamanho das partículas responsáveis pelo espalhamento. Muito importante nas medidas de Turbidez)
espalhamento Raman, que pode ser do tipo Stokes (em maior comprimento de onda) ou anti-Stokes (em menor comprimento de onda)
emissão de Fluorescência
Review of Student-Built Spectroscopy Instrumentation Projects
Analytical devices based on light-emitting diodes - a review of the state-of-the-art
Activity Analysis of Iron in Water Using a Simple LED Spectrophotometer
Low cost analyzer for the determination of phosphorus based on open-source hardware and pulsed flows
Simplified Low-Cost Colorimetry for Education and Public Engagement
A concept of dual optical detection using three light emitting diodes
Construction of a Photometer as an Instructional Tool for Electronics and Instrumentation
Com indicação da fórmula para a determinação do LOQ (Limite de Quantificação)
LIGHT EMITTING DIODE BASED FLOW-THROUGH OPTICAL ABSORPTION DETECTORS
Artigo de 1993 com sugestões de cela de fluxo “embutidas” no próprio LED
Artigo de 1994 com sugestões para compensar o “Efeito Schlieren” em sistemas de análise em fluxo.
The Characterization of an Easy-to-Operate Inexpensive Student-Built Fluorimeter
Artigo inclui medidas de fluorescência da clorofila do espinafre.
Artigo com uma proposta semelhante ao “Multifotômetro”.
Artigo com a mesma proposta do “Multifotômetro”.